“快乐因子”竟能减轻AD症状,改善记忆力
近年来,“多巴胺”的风刮得很大。从“快乐激素多巴胺”到“夏日多巴胺穿搭”,多巴胺逐渐从一个医学名词转变为一种“生活情绪与态度”。
回归本质。多巴胺(Dopamine)是一种由神经元释放并用以传递信息的重要神经递质,在调节情绪、动机、奖励感受以及运动控制等方面发挥着重要作用。
之所以称多巴胺为“快乐因子”,是因为这种激素与情绪调节息息相关,比如体育锻炼、享受美食、热恋期间等等,多巴胺便会像烟花一般在大脑中绽放,进一步激活奖励系统,让人体验到快乐、兴奋等积极情绪。
当然,多巴胺并不只是个“快乐的小精灵”,它还具有广泛的生理作用。举例来说,多巴胺在退行性疾病帕金森病的治疗中发挥着重要作用,它的前体化合物左旋多巴(L-DOPA)是目前治疗帕金森病的常用方法,L-DOPA进入中枢系统后经过反应转化为多巴胺,发挥对抗帕金森疾病的作用。由于多巴胺和L-DOPA的发现,瑞典化学家Arvid Carisson教授获得了2000年诺贝尔生理学或医学奖。
近日,Science Signaling上最新刊登的研究进一步探索出了多巴胺的新作用——抵御阿尔茨海默症(AD)!研究者发现,多巴胺治疗能够减轻AD小鼠大脑的生理症状,改善其记忆力。基于此,研究者乐观地认为,未来或能在AD的治疗领域看到多巴胺及L-DOPA“大展身手”。
DOI: 10.1126/scisignal.adk1822
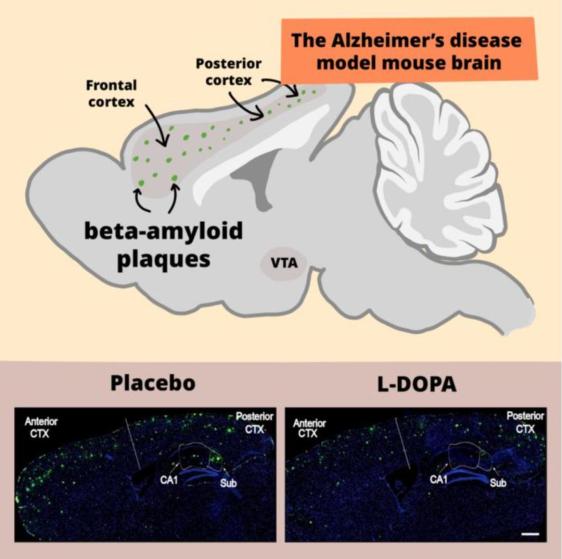
相信大家对AD并不陌生。AD是一种进行性的神经退行性疾病,会引起思维、记忆和独立性受损,严重影响生活质量。AD的发病机制非常复杂,其中,由合成和分解代谢失衡所致的病理性蛋白——淀粉样蛋白-β(Aβ)的积累,被认为是AD的重要诱因。
探究多巴胺与AD之间关系之前,还要引入一个新概念——脑啡肽酶(NEP)。NEP是一种内源性蛋白酶,能够有效地降解Aβ;但随着年龄的增长,NEP的表达和活性会有所降低。而AD患者脑内的NEP水平就更低了,先前研究显示,缺乏NEP基因的小鼠大脑中Aβ水平约为正常对照组的2倍。
但问题是,药丸或注射剂形式的NEP并不可行,它无法从血流直接进入大脑。想要上调NEP水平还得“曲线救国”,于是研究者思考,“是否能找到某种化合物通过上调脑内NEP活性来改善AD呢”?
基于先前研究,研究者将搜索范围缩小到下丘脑分泌的激素上,并进一步通过体外实验精准地找到了多巴胺,发现只有多巴胺能够增加共培养神经元的NEP活性。
紧接着,采用小鼠实验进一步测试了多巴胺的作用,观察到多巴胺能够明显降低野生小鼠中Aβ水平,但NEP基因敲除小鼠中则没有观察到类似的情况,即多巴胺能以NEP介导的方式降低Aβ水平。
通过上调NEP,DA调节了培养基中Aβ水平
实验正式开始!
为了分析大脑内NEP调节过程中多巴胺的生理作用,研究者使用了“只由特定药物激活的受体”(DREADD, Designer receptors exclusively activated by designer drugs)的系统,在小鼠中脑腹侧被盖区中产生多巴胺的神经元中植入了微小的设计型受体。
通过在食物中添加匹配的设计药物,小鼠大脑中产生多巴胺的神经元被持续激活,且只有这些神经元被激活了。结果与培养皿中的情况类似,激活的神经元不断释放出多巴胺,进一步增加了NEP水平,并减少了自由浮动的Aβ。
接下来,来到研究者最感兴趣的问题:在AD模型中,这种疗法同样起作用吗?于是,他们在特殊的阿尔茨海默症小鼠模型中重复了这项试验。结果显示,经过8周的治疗之后,小鼠前额叶皮质中的Aβ斑块明显减少。
多巴胺激活了NEP表达
虽然DREADD系统是精确操控特定神经元的绝佳系统,但它无法在人类临床环境中复用。是否有办法往机体内引入多巴胺呢?又会产生怎样的效果呢?
于是,研究者想到了阿尔茨海默症的治疗药物L-DOPA。L-DOPA是多巴胺的前体分子,能够从血液进入大脑并进一步转化为多巴胺。
使用L-DOPA治疗后,大脑额叶和后部的NEP显著增加,且Aβ斑块减少;与此同时,3个月的L-DOPA治疗后,小鼠的记忆测试结果也明显优于未治疗组,提示该组的AD得到明显改善。
使用L-DOPA治疗AD的情况
综上,结合化学遗传学和药理学方法,研究者发现多巴胺能够调节NEP的表达,尤其是在大脑前皮层。在L-DOPA治疗下,小鼠的Aβ斑块有所减少,同时AD小鼠异常的记忆功能也得到了改善。
基于上述实验,期待多巴胺以及其前体化合物L-DOPA用于治疗阿尔茨海默症的临床试验早日启动,让“快乐因子”也给更多的AD患者带去快乐!
参考资料:
[1]Naoto Watamura et al.,The dopaminergic system promotes neprilysin-mediated degradation of amyloid-β in the brain.Sci. Signal.17,eadk1822(2024).DOI:10.1126/scisignal.adk1822
[2]https://www.eurekalert.org/news-releases/1053614
上一新闻:中医对感官的运用令人们信服
下一新闻:古典音乐如何提升我们的情绪……


